近年来,类器官在抗癌药研发中受到更多的关注,肿瘤类器官模型不仅能展现原肿瘤组织的结构与功能,还可充分体现肿瘤的异质。类器官培养技术可以通过体外扩增培养得到大量肿瘤类器官,因此在肿瘤药物的开发与中高通量筛选上有着得天独厚的优势。但它的应用受到细胞处理技术门槛和工艺成本的限制。
近年来,类器官在抗癌药研发中受到更多的关注,肿瘤类器官模型不仅能展现原肿瘤组织的结构与功能,还可充分体现肿瘤的异质。类器官培养技术可以通过体外扩增培养得到大量肿瘤类器官,因此在肿瘤药物的开发与中高通量筛选上有着得天独厚的优势。但它的应用受到细胞处理技术门槛和工艺成本的限制。
本次案例使用迪必尔生物全新推出的 MiniWave 高通量微型波浪式反应器来验证肿瘤细胞悬浮培养形成成球类器官的可行性。
设备:MiniWave 高通量微型波浪式反应器
CFD模拟:使用计算流体力学(CFD)模拟了T25细胞培养瓶的剪切应力和能量耗散,以此为依据进行反应器参数的设置。
培养验证:将肝癌细胞(HCC)细胞接种于含10%胎牛血清(FBS)的RPMI1640培养基中,以8.0 × 105 cells/mL的细胞密度接种于T25细胞培养瓶中,摇摆转速和角度分别设置为20 rpm和15°。
检测:每天用光学显微镜监测细胞成球情况。4天后收获球形肝癌类器官,使用10%中性福尔马林固定,石蜡包埋,切片。切片采用苏木精-伊红(HE)鉴定组织结构,免疫组化(IHC)染色检测Ki67、AFP和mTOR这三种生物标志物。在光镜下检查染色材料,并捕获荧光图像。
CFD模拟:CFD 的结果表明,在不同的摇摆速度下,剪切应力较高的区域集中在 T25 细胞培养瓶底部和液气交界处。由于流场的非均匀性,最大剪切应力显著高于平均值。在摇速为20 rpm时,平均剪应力小于100 mPa。在T25中培养到第4天,肝细胞癌类器官的直径可达200 μm。
图2 不同摇摆速度下T25的CFD模拟结果
(a)液气界面速度大小等高线
(b)平均和最大剪应力的周期性趋势
类器官鉴定:HE染色结果显示培养的类器官表现出与肝细胞癌一致的组织结构特征。免疫组化分析显示,类器官模型中生物标志物Ki67、AFP和mTOR的阳性表达,与上述发现一致,免疫荧光结果也证实了这一点。
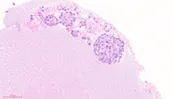
图4 免疫组化染色生物标志物表达(Ki67、AFP和mTOR)
图6 培养过程(第0天~第4天)光镜下肿瘤类器官球体的形成
使用 MiniWave 高通量微型波浪式反应器进行肝癌类器官培养,辅以优化的培养方案可以显著提高肿瘤细胞来源的类器官培养效率。至关重要的是,这种方法保持了在原始肿瘤中观察到的肿瘤标志物的形态学特征和表达模式。
MiniWave 专为细胞悬浮培养、微载体培养及贴壁培养设计,是一款多功能的摇摆式高通量生物反应器产品。
设备整合16个独立控制电机和支架,可放置16个T25细胞培养瓶,支持同步或独立的转速及倾角控制。系统自动监测、控制反应器内CO₂浓度、温度以及湿度,采用高温干式灭菌,支持状态异常报警。
可配置Cell-Counter进行细胞密度检测。

本文改编自BioProcess International US West(BPI WEST 2024) Poster
《Enhancing Cancer Organoid Culture Efficiency:
A Novel Suspension Method Utilizing Tumor-Derived Cells》
原文作者:解正刚 曹灿 张君轩