大肠杆菌
高密度发酵
大肠杆菌是重组蛋白(RPs)最有效的表达宿主之一。具有表达系统清晰、培养成本低、操作简单、生长速度快等优势。被广泛应用于生物制药领域。
高细胞密度发酵是指在一定的培养体系内,利用改变培养方式或培养条件的方法,提高菌体生物培养密度,进而增加目标产物产量。
影响因素主要有:
① 培养基成分
② 菌种接种量
③ 培养温度
④ 发酵液pH
⑤ 溶氧
⑥ 补料策略
⑦ 诱导方式
⑧ 生长抑制物的积累 E. coli
本实验采用迪必尔生物的一次性生物反应器(3L)系统,包含了最大体积为3L的一次性硬质发酵罐体和T&J-Intelli-Ferm A系列控制器(图1)。

图1 T&J-Intelli-Ferm A 台式生物反应器
该系统符合cGMP药品生产规范。具有易于安装的特点,且兼容玻璃罐体配件,可快速转移研发管线(图2),提高工艺开发效率,让研究者只需关注工艺开发。

图2 一次性罐体结构
为了验证该款一次性生物反应器能否满足高细胞密度发酵,我们用大肠杆菌(BL21)在一次性生物反应器(3L)上进行了两次测试。
两次测试工作体积均为1.5L,接种量为工作体积的2%,并在发酵运行9h左右开始补料,24h结束培养,最终OD600分别达到84、79,验证了一次性生物反应器(3L)能为大肠杆菌提供适宜的生长环境,满足大肠杆菌的高密度发酵培养。
发酵过程中的溶氧变化可以反应菌株的生长情况。从接种开始,溶氧随发酵进行逐渐降低,当溶氧低于设定值30%时触发溶氧关联,搅拌、通气逐渐上升,直至溶氧值突然激增,此时发酵液内营养物质消耗殆尽,开启补料关联控制。此后在理想状态下溶氧会在设定值附近波动(图2),若溶氧波动较大则需要调整补料策略,如更改补料速度、补料关联模式。
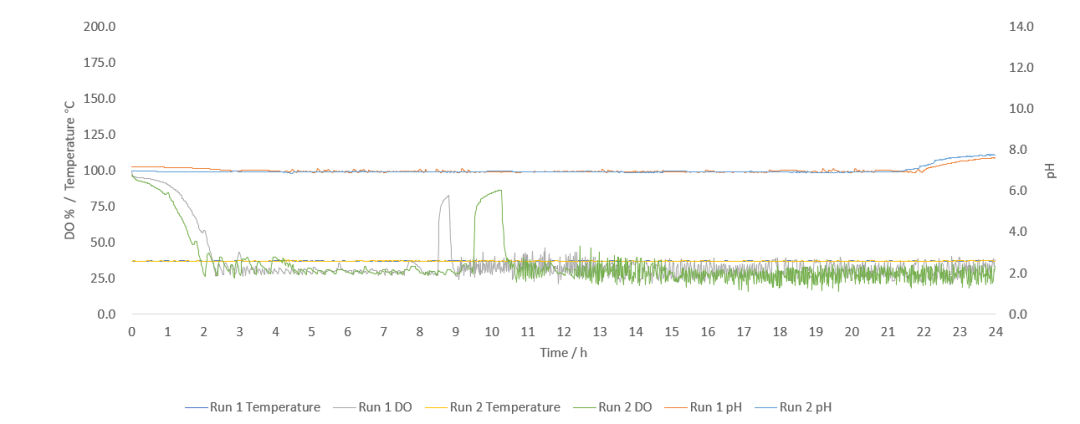
图2 两次实验温度、溶氧、pH变化曲线
OD600可以反应菌种的密度。若OD600上升变缓或开始下降,则表明菌株已进入生长末期,可以结束批次培养。
经过24h的发酵培养,第一次实验菌株OD600从摇瓶2.56增加至84,第二次实验菌株OD600从摇瓶1.62增加至79,均有较高的增殖(表1)。

表1 两次实验各阶段OD600数值
本次实验使用基础培养基,未添加微量元素、生物素等。两批菌株经过24h的培养,在装液量1.5L、接种量2%的条件下,都有较好的生长。在同等工艺条件下,迪必尔一次性生物反应器(3L)能达到玻璃生物反应器同等水平。
实验说明大肠杆菌在迪必尔一次性生物反应器(图3)能有较好的生长,实验中一次性生物反应器系统的温度、pH控制较为平稳,溶氧波动较小,能为菌株提供良好的生长环境。

图3 迪必尔一次性生物反应器(3L)系统
实验使用的T&J-Intelli-Ferm A系列控制器,罐体从3L到15L可选,软件界面整合了多种补料策略及DO级联方式,是理想的缩小及放大应用发酵罐,适于所有的微生物培养,可轻松做到高密度发酵培养。